Au Centre d’Infection et d’Immunité de Lille (CIIL) de l’Institut Pasteur de Lille, Inès Leleu, chercheuse post-doctorante, explore les liens encore méconnus entre infections, immunité et cerveau. Dans cette interview, elle revient sur un parcours marqué par l’étude du neuropaludisme, de la neuroinflammation et du rôle clé du microbiote intestinal. Elle éclaire les raisons pour lesquelles certaines personnes développent des formes graves d’infections, l’influence de notre mode de vie sur l’immunité et les pistes de prévention envisageables. Elle partage également les grands défis à venir : mieux comprendre les atteintes cérébrales liées aux infections, identifier des biomarqueurs précoces et décrypter les mécanismes de vieillissement du cerveau pour améliorer la santé de demain.

Rencontre avec le Dr Inès Leleu, post-doctorante au Centre d’Infection et d’Immunité de Lille et engagée sur le Projet ERA4TB.
Vous avez travaillé pendant plusieurs années sur les infections cérébrales graves comme le neuropaludisme, et poursuivez aujourd’hui vos recherches autour du cerveau. Quelles sont les grandes étapes de votre parcours scientifique et les thématiques qui vous passionnent ?
Inès Leleu (IL) : J’ai un parcours atypique, débuté par un double master : en biologie-santé à l’Université de Lille, puis en parasitologie et mycologie à l’Université Paris-Sorbonne. Dès mon premier stage, en 2016, j’ai intégré l’équipe du Dr Sylvianne Pied au Centre d’Infection et d’Immunité de Lille (CIIL) à l’Institut Pasteur de Lille). Séduite par la richesse des thématiques de recherche, j’y suis restée six ans en tant qu’ingénieure d’étude. Mes travaux portaient sur le neuropaludisme (NP), la forme cérébrale et mortelle du paludisme, la parasitose la plus meurtrière au monde. Je me suis particulièrement intéressée au rôle des astrocytes, principales cellules du cerveau, dans les processus neuroinflammatoires associés à la maladie, ainsi qu’à l’influence de facteurs de risque tels que le microbiote intestinal.
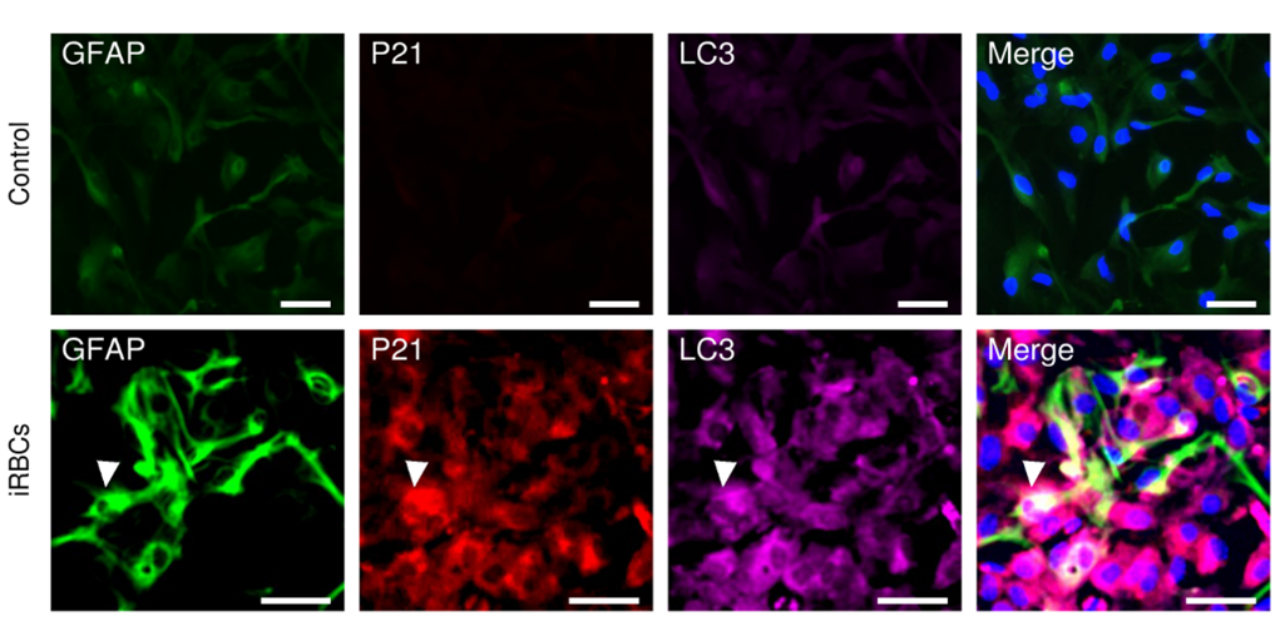
J’ai notamment mis en évidence le rôle d’un mécanisme de défense cellulaire, l’autophagie, dans la dégradation des microvésicules parasitaires. Ce processus déclenche une réponse inflammatoire contribuant à la pathologie, ainsi qu’un état de sénescence susceptible d’expliquer le vieillissement cérébral précoce et les troubles neurologiques et cognitifs observés chez les survivants. Ce projet, riche en collaborations, m’a également permis de réaliser des séjours de recherche en Inde et en Guyane française, en lien avec notre équipe, afin d’explorer d’autres aspects des interactions entre parasites, les cellules cérébrales et l’immunité. Et c’est encouragé par Sylviane Pied, que j’ai débuté en 2021 et soutenue en 2023 une thèse à l’Université de Guyane portant sur le rôle des astrocytes dans le neuropaludisme et la co-infection Plasmodium-Toxoplasma.
Aujourd’hui, je suis chercheuse post-doctorante dans le groupe d’Alain Baulard, au sein de l’équipe “Recherche sur les Mycobactéries et les Bordetelles (RMB)” dirigée par la Dr. Nathalie Mielcareck. J’y poursuis mes travaux sur les interactions hôte–pathogène dans le contexte de la tuberculose, en collaboration avec le Dr. Arnaud Machelart, thématique riche au berceau historique du vaccin BCG. Passionnée par la recherche sur le cerveau et la neuroimmunologie dans le contexte des infections, je souhaite à terme développer mon propre projet de recherche à l’Institut Pasteur de Lille, consacré aux formes cérébrales de la tuberculose, notamment les méningites tuberculeuses, afin d’en élucider les mécanismes immunitaires et cellulaires, notamment le rôle des astrocytes, impliqués dans ces infections sévères du système nerveux central.
L’une de vos questions centrales concerne la vulnérabilité face aux infections : pourquoi certaines personnes développent-elles des formes graves alors que d’autres s’en sortent mieux ? Quels facteurs entrent en jeu ?
IL : Quand on parle d’infections, qu’elles soient saisonnières comme la grippe ou endémiques, il ne faut jamais oublier qu’elles peuvent rester potentiellement mortelles. La sensibilité aux infections varie beaucoup d’une personne à l’autre, et elle dépend souvent de l’état du système immunitaire. Certaines populations sont particulièrement à risque de formes graves : les enfants de moins de cinq ans, dont l’immunité et le schéma vaccinal ne sont pas encore complets, les femmes enceintes, dont le système immunitaire devient plus tolérant pour protéger le fœtus, et les personnes immunodéprimées ou âgées, qui ont plus de difficultés à combattre les infections. Si le corps ne peut pas se défendre dès le départ, l’infection peut persister et se propager à différents organes, y compris le cerveau, ce qui provoque des complications graves.
À cela s’ajoutent des facteurs génétiques et épigénétiques qui influencent notre réponse aux infections. Par exemple, le groupe sanguin peut jouer un rôle : les personnes de groupe O attirent davantage certains moustiques, en plus d’autres facteurs comme la sueur ou la composition de la peau.
Ensuite, il y a les facteurs externes liés à l’environnement et aux comportements. Vivre dans des zones où certaines maladies sont endémiques expose davantage aux pathogènes, et la co-infection par plusieurs microbes peut parfois augmenter le risque, ou au contraire offrir une protection. Lors de ma thèse, nous avons montré que la coinfection d’un sujet sensible par Toxoplasma gondii et Plasmodium les protégeaient du NP, contrairement aux sujets infectés uniquement par Plasmodium. De même, l’hygiène, le tabac, l’alimentation, la prise de médicaments ou encore le microbiote intestinal jouent un rôle important dans notre vulnérabilité.
En résumé, la gravité des infections dépend d’un ensemble complexe de facteurs biologiques, environnementaux et comportementaux, qui varient d’une personne à l’autre.
Vous explorez notamment le rôle du microbiote intestinal dans cette vulnérabilité. En quoi notre alimentation ou notre mode de vie influencent-ils notre immunité face aux infections ?
IL : D’abord, il est important de préciser que le microbiote intestinal est une véritable communauté de micro-organismes — bactéries, virus, champignons — qui vit dans nos intestins. Dit comme ça, ça peut faire un peu peur ! Mais rassurons-nous, en réalité, « ces microbes » sont loin d’être dangereux ! Au contraire, ils sont indispensables non seulement pour la digestion mais surtout à notre santé et à notre système immunitaire. C’est une symbiose parfaite que l’on entretient avec eux.
Cependant, lorsque le microbiote intestinal est déséquilibré, il peut devenir un facteur de vulnérabilité face aux infections. Dans l’équipe du Dr Pied, nous avons étudié l’influence et le rôle du microbiote dans le développement du NP, en utilisant des antibiotiques pour déstabiliser la flore intestinale. Nous avons montré que modifier le microbiote intestinal pouvait soit protéger des sujets sensibles contre un NP, soit à l’inverse, rendre plus sensibles les sujets normalement moins prédisposés à être malades, selon leur profil initial. Cette protection vient de petites molécules produites par le microbiote, qu’on appelle acides gras à chaines courtes, qui circulent jusqu’au cerveau et réduisent la neuroinflammation, responsable du coma et de la mortalité dans cette maladie.
Le microbiote intestinal est un élément clé qui influence notre sensibilité à développer une maladie, qu’elle soit bénigne ou grave. Il est fortement modulé par notre alimentation et notre mode de vie. La malnutrition fréquente dans les zones d’endémie, mais aussi en Europe, comme le manque d’allaitement qui prive le nouveau-né de la transmission du microbiote maternel et des anticorps protecteurs, fragilisent cet équilibre. Une hygiène excessive, notamment la stérilisation systématique, limite l’entraînement du système immunitaire, tandis que la consommation régulière d’aliments ultra-transformés, pauvres en nutriments et en bons apports comme les produits laitiers ou les vitamines, perturbe également la flore intestinale. Enfin, l’usage excessif d’antibiotiques — qui ne sont efficaces que contre les bactéries je le rappelle — aggrave encore ce déséquilibre et affaiblit nos défenses naturelles.
En résumé, un microbiote sain dépend d’une bonne alimentation et d’habitudes de vie adaptées. Protéger et entretenir cette flore dès l’enfance est crucial, car elle influence notre immunité tout au long de la vie. Promouvons le « manger bien, manger sain, pour vivre le plus longtemps en bonne santé ! ».
Une mauvaise alimentation, la sédentarité ou le tabagisme augmentent les risques, en déséquilibrant le microbiote. Sans forcément en avoir conscience, notre mode de vie quotidien peut déjà nous aider à devenir plus résistants face aux infections.
IL : Il ne faut pas attendre d’être malade pour prendre soin de sa santé ! On sait aujourd’hui qu’une bonne hygiène de vie — une alimentation équilibrée, riche en fruits et légumes, une bonne hydratation et une activité physique régulière — renforce nos défenses naturelles et nous rend moins vulnérables aux infections. À l’inverse, une mauvaise alimentation, la sédentarité ou le tabagisme augmentent les risques, en déséquilibrant le microbiote. Sans forcément en avoir conscience, notre mode de vie quotidien peut déjà nous aider à devenir plus résistants face aux infections. Comme on le dit souvent, un esprit sain dans un corps sain !
Pour les personnes plus fragiles, des approches complémentaires comme les probiotiques, qu’on retrouve dans certains yaourts ou compléments alimentaires, se montrent prometteuses. Ils aident à rééquilibrer le microbiote intestinal et peuvent renforcer la résistance aux infections, notamment lors des périodes de grippe saisonnière. Le défi reste de rendre ces traitements accessibles aux populations des zones endémiques, souvent les plus touchées.
Mais au-delà des traitements, la prévention reste essentielle : l’usage de moustiquaires, la réduction des piqûres d’insectes, une meilleure reconnaissance des symptômes et un accès rapide aux soins sont des gestes simples mais efficaces.
Enfin, il faut rappeler que beaucoup d’infections sont liées à l’environnement. Avec le changement climatique, certaines maladies réapparaissent dans des régions où elles avaient disparu — comme le paludisme au Maghreb ou le chikungunya en France. Cela montre à quel point la santé humaine est liée à celle de notre environnement. En prenant soin de nous-même et de la planète, on protège aussi notre propre santé et celle des générations futures.
Vieillissement prématuré du cerveau, infections, déséquilibres du microbiote… quels sont selon vous les grands défis de demain dans la compréhension du lien entre cerveau, immunité et environnement ?
IL : Le cerveau est un organe à la fois fascinant et difficile à étudier. Contrairement à d’autres organes et malgré les avancées technologiques récentes, il reste complexe à observer directement, ce qui rend l’analyse de ses atteintes lors d’infections particulièrement délicate. Comprendre comment certaines infections provoquent des formes cérébrales graves est donc un vrai défi scientifique.
Dans le cadre du paludisme sévère, j’ai récemment montré qu’un vieillissement prématuré du cerveau peut survenir après un épisode de NP. Ce phénomène de sénescence accélérée entraîne des troubles cognitifs, neurologiques et, chez certains enfants, une mortalité précoce à l’âge adulte.
L’un des grands enjeux de demain sera de développer des outils de diagnostic plus rapides et fiables, notamment grâce à l’identification de biomarqueurs dans le sang. Ces marqueurs pourraient permettre de détecter plus tôt les formes graves et d’adapter les traitements.
Enfin, il est essentiel de mieux comprendre comment les infections déclenchent une inflammation cérébrale chronique, impliquant notamment les astrocytes, ces cellules majoritaires du cerveau qui, lorsqu’elles s’activent de manière prolongée, provoquent des dommages irréversibles.
Ces recherches sont cruciales pour établir des liens entre infection, neuroinflammation et vieillissement cérébral, et ouvrir de nouvelles pistes dans la prévention et le traitement des maladies neurodégénératives comme la maladie d’Alzheimer ou Parkinson. En résumé, la recherche sur les formes cérébrales des infections reste un champ encore peu exploré mais essentiel, qui nécessite de nouvelles méthodes et une meilleure compréhension des interactions entre pathogènes et cerveau pour améliorer la santé à long terme.