Efficacité et résistance aux thérapies ciblées anti-tumorales
UMR Canther CNRS 9020 – Inserm S 1277 – Université de Lille – CHU Lille – Institut Pasteur de Lille
Présentation
Ces dix dernières années, l’émergence des thérapies ciblées a profondément modifié la prise en charge des patients présentant une addiction oncogénique, avec une amélioration de leur condition et de leur espérance de vie. Cependant, toutes les thérapies ciblées doivent faire face à l’émergence de résistances conduisant systématiquement à des échecs thérapeutiques. De plus, de nombreux cancers sont toujours diagnostiqués à un stade métastatique, une étape de la maladie ou les traitements sont peu efficaces et qui reste donc associée à un mauvais pronostic.
L’objectif global de notre équipe de recherche est de décrypter les mécanismes moléculaires conduisant à l’addiction oncogénique, puis au processus de résistance, dans le but d’améliorer l’efficacité des thérapies ciblées. Nous concentrons notre attention sur le cancer du poumon et de la prostate et leur stade métastatique, représentant à eux deux la cause principale de mortalité par cancer. Nous tirons avantage de notre expertise sur des oncogènes dont l’implication dans chacun de ces cancers est bien documentée, incluant les récepteurs à activité tyrosine kinase (RTK) et les gènes de fusion ETS. Nous développons également de nouvelles approches thérapeutiques dans le but de corriger les mutations non-sens représentant de 5 à 40% des mutations affectants les gènes suppresseurs de tumeurs et responsable d’environ 10% des maladies génétiques. Nous avons délibérément choisi de travailler en collaboration étroite avec les biologistes moléculaires, les pathologistes et les cliniciens du CHU de Lille qui sont directement impliqués dans la prise en charge des patients.
Actus
- Nous avons récemment isolé à partir d’un extrait de champignon la DAP (2,6 diaminopurine), un composé capable de favoriser la translecture d’ARNm contenant des mutations non-sens (codon stop). Suite à cette identification, nous avons cherché à mettre en évidence son mode d’action. Il s’avère que la DAP est capable d’interférer avec l’activité d’une enzyme la FTSJ1 impliquée dans la régulation de l’activité des ARN de transfert. Ainsi, cette molécule inhibe in vivo la croissance de cellules tumorales présentant des mutations non-sens de p53, ouvrant sur de nouvelles stratégies de thérapies ciblées antitumorales (Trzaska et al., Nat Commun. 2020).Communiqué de presse INSERM https://presse.inserm.fr/un-champignon-au-secours-des-patients-atteints-de-maladies-genetiques-rares/38698/
- Des thérapies ciblées contre le récepteur MET sont depuis très récemment administrées à des patients atteints d’un cancer du poumon et présentant des mutations de MET. Cependant, ces patients présentent des résistances limitant l’efficacité de la thérapie. En partant d’échantillons de patients traités à Lille et en reconstituant des lignées cellulaires résistantes, nous avons identifié un de ces mécanismes de résistance impliquant une réactivation de la voie PI3K. Ces travaux ouvrent la possibilité de stratégies de co-traitement pour contrecarrer les résistances (Jamme et al, J Thorac Oncol 2020).Nous avions démontré que MET est un récepteur à dépendance capable d’induire soit la survie cellulaire en présence de ligand, soit la mort cellulaire en son absence. Par la création de souris knock-in, nous avons montré cette année que cette double fonction est importante pour réguler la balance survie/apoptose dans un organisme et notamment dans le foie. Il est possible que ces fonctions de MET soient également importantes durant la tumorigenèse (Duplaquet et al, ELife, 2020).Communiqué de presse CNRS https://insb.cnrs.fr/fr/cnrsinfo/le-recepteur-met-une-des-clefs-de-lequilibre-des-forces-entre-vie-et-mort-cellulaire
- L’équipe a démontré que MET est un récepteur à dépendance capable d’induire soit la survie cellulaire en présence de ligand, soit la mort cellulaire en son absence. Par la création de souris knock-in, nous avons montré cette année que cette double fonction est importante pour réguler la balance survie/apoptose dans un organisme et notamment dans le foie. Il est possible que ces fonctions de MET soient également importantes durant la tumorigenèse (Duplaquet et al, ELife, 2020).


Projet transversal
 COVID-19
COVID-19
L’équipe Target s’est impliquée directement dans la lutte contre la COVID-19 en obtenant un financement Flash COVID par l’ARC (porteur Martine Duterque-Coquillaud). Le projet a pour objectif d’évaluer l’influence des androgènes sur l’infection virale. En effet, l’expression de certains récepteurs du virus est connue pour être dépendante des androgènes dans certains organes comme la prostate. Ce projet est mené en collaboration avec l’équipe du Dr François Trottein au Centre d’Infection et d’Immunité de Lille (campus IPL) et avec le CHU de Lille. Ce projet pourrait permettre d’expliquer les formes graves de COVID-19.

Membres
David TULASNE
DR2 Inserm, responsable de l’équipe
Numéro ORCID : 0000-0002-6764-7242
Martine DUTERQUE-COQUILLAUD
DR2 CNRS
Numéro ORCID : 0000-0003-3943-5629
Anne CHOTTEAU-LELIEVRE
PR2 Univ Lille
Zoulika KHERROUCHE
CR1 IPL
Numéro ORCID : 0000-0003-0666-5698
Marie-José TRUONG
Chercheur IPL
Numéro ORCID : 0000-0001-6697-6266
Fabrice LEJEUNE
CRCN Inserm
Numéro ORCID : 0000-0002-5132-3585
Marie-Hélène VIEILLARD
Onco-Rhumatologue, COL et CHU Lille
Sarah HUMEZ
Anatomo-Pathologiste, CHU Lille
Arnauld VILLERS
Urologue – PU-PH, CHU Lille
Numéro ORCID : 0000-0002-6298-7758
Xavier LEROY
Anatomo-Pathologiste – PU-PH, CHU Lille
Alexis CORTOT
Pneumologue – PU-PH, CHU Lille
Simon BALDACCI
Pneumologue, CHU Lille
Catherine AMPEN-GUFFROY
IE CNRS
Virginie POIX
IE CNRS, CDD
David HANNEBIQUE
AI CNRS (Animalerie)
Anne-Claire FLOURENS
Technicienne Inserm
Nathalie VANPOUILLE
Technicienne IPL
Isabelle DAMOUR
Technicienne IPL
Audrey VINCHENT
Technicienne IPL
Marie FERNANDES
Étudiante en thèse, Univ Lille
Anthony TURPIN
Étudiant en thèse, Univ Lille – Oncologue, CHU Lille
Martine PALMA
Étudiante en thèse, Univ Lille
Jonathan OLIVIER
Étudiant en thèse, Univ Lille – Urologue, CHU Lille
Célia GUERIN
Étudiante en thèse, Univ Lille
Elisa CAROUGE
Étudiant en thèse, Univ Lille
Publications
Duplaquet L, Leroy C, Vinchent A, Paget S, Lefebvre J, Vanden Abeele F, Lancel S, Giffard F, Bidaux G, Heliot L, Poulain L, Furlan A and Tulasne D.
Control of cell death/survival balance by the MET dependence receptor.
Elife. 2020 Feb 24;9. IF 7.551.
Jamme P, Fernandes M, Copin MC, Descarpentries C, Escande F, Morabito A, Grégoire V, Jamme M, Baldacci S, Tulasne D, Kherrouche Z, and Cortot AB.
Alterations in the PI3K pathway drive resistance to MET inhibitors in NSCLC harboring MET exon 14 skipping mutations. Journal of Thoracic Oncology.
2020 Mar 10. IF 12.460.
Trzaska C, Amand S, Bailly C, Leroy C, Marchand V, Duvernois-Berthet E, Saliou JM, Benhabiles H, Werkmeister E, Chassat T, Guilbert R, Hannebique D, Mouray A, Neu-Yilik G, Copin MC, Moreau PA, Prévotat A, Reix P, Hubert D, Gérardin M, Adriaenssens E, Hentze M, Kulozik A, Westhof E, Tulasne D, Motorin Y, Rebuffat S and Lejeune F.
2,6-Diaminopurine as a highly potent corrector of UGA nonsense mutations.
Nat Commun. 2020 Mar 20;11(1):1509. IF 11.878.
Baldacci S, Figeac M, Antoine M, Descarpentries C, Kherrouche Z, Jamme P, Copin MC, Tulasne D, Nanni I, Beau-Faller M, Melaabi S, Levallet G, Quoix E, Moro-Sibilot D, Friard S, Missy P, Barlesi F, Cadranel J, and Cortot AB.
High MET overexpression does not predict the presence of MET exon 14 splice mutations in NSCLC : results from the IFCT Predict.amm study. Journal of Thoracic Oncology.
2020 Jan;15(1):120-124. IF 12.460.
[Delliaux C, Tian TV], Bouchet M, Fradet A, Vanpouille N, Flourens A, Deplus R, Villers A, Leroy X, Clézardin P, de Launoit Y, Bonnelye E, Duterque-Coquillaud M.
TMPRSS2:ERG gene fusion expression regulates bone markers and enhances the osteoblastic phenotype of prostate cancer bone metastases.
Cancer Lett. 2018 Dec 1;438:32-43. IF 6.508.
Mots-clés
Cancer ; Poumon ; Prostate ; Récepteur MET ; Facteurs de transcription ETS ; Régulation transcriptionnelle ; Contrôle qualité des ARNm ; Dépistage ; MRI ; Morphométrie ; Facteurs de progression ; Grade histo-pronostique ; Métastases ; Mutation non-sens ; Nonsense-mediated mRNA decay (NMD) ; Translecture ; Approches thérapeutiques ciblées ; Criblage ; Maladies génétiques Modèle murin de cancer du sein ; Microenvironnement tumorale ; Cellules immunitaires ; Lymphocytes infiltrants ; Récepteur tyrosine kinase ; Signalisation intracellulaire ; Gènes suppresseurs de tumeurs ; Balance survie apoptose ; Thérapies ciblées, Résistance ; Metastases osseuses ; ETS fusion ; Récepteur tyrosine kinase
Contact équipe
David Tulasne
Responsable de l’équipe
david.tulasne@ibl.cnrs.fr
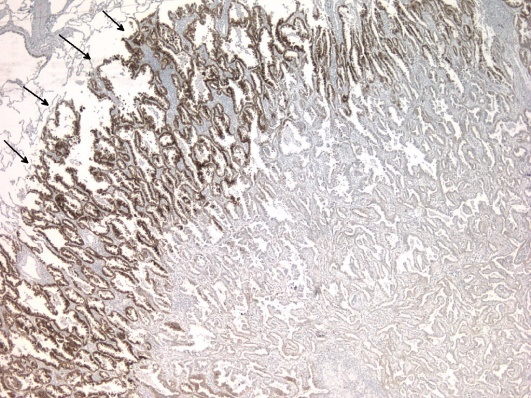
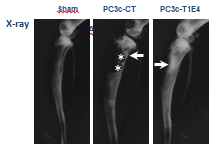
Tumeur pulmonaire exprimant le récepteur MET au front d’invasion.
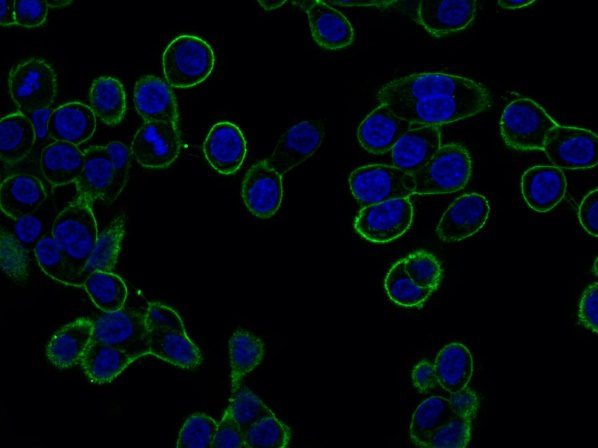
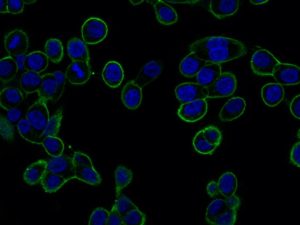
GTL16 cancer cells expressing MET receptor at plasma membrane (green staining).
Colocalisation dans des foyers cytoplasmiques de cellules HeLa de UPF1 (en vert) et de DCP1a (en rouge) suite à un traitement par la colchicine.