Chronicité des Infections Virales [CVI]

Présentation
 L’équipe « Chronicité des Infections Virales » étudie les mécanismes moléculaires et cellulaires liés à la persistance des pathogènes dans les cellules myéloïdes. Nos objectifs sont : i) d’investiguer de nouvelles stratégies pour neutraliser les agents pathogènes avant qu’ils se cachent et se protègent dans des réservoirs tissulaires ou cellulaires (tels que les macrophages et autres cellules myéloïdes, y compris leurs progéniteurs hématopoïétiques); ii) d’étudier les mécanismes de latence des pathogènes intracellulaires responsables de la persistance de la maladie; et iii) de cibler la propagation de l’agent pathogène à partir de ces niches cellulaires. Notre recherche vise à lutter plus efficacement contre les infections virales chroniques et potentiellement mortelles. Nous étudions les dysfonctionnements immunitaires à long terme causés par le VIH-1 (SIDA) et le SRAS-CoV-2 (COVID-19) hébergés par les macrophages, les mégacaryocytes et leurs précurseurs, afin de concevoir des stratégies thérapeutiques contre VIH/SIDA et le COVID long.
L’équipe « Chronicité des Infections Virales » étudie les mécanismes moléculaires et cellulaires liés à la persistance des pathogènes dans les cellules myéloïdes. Nos objectifs sont : i) d’investiguer de nouvelles stratégies pour neutraliser les agents pathogènes avant qu’ils se cachent et se protègent dans des réservoirs tissulaires ou cellulaires (tels que les macrophages et autres cellules myéloïdes, y compris leurs progéniteurs hématopoïétiques); ii) d’étudier les mécanismes de latence des pathogènes intracellulaires responsables de la persistance de la maladie; et iii) de cibler la propagation de l’agent pathogène à partir de ces niches cellulaires. Notre recherche vise à lutter plus efficacement contre les infections virales chroniques et potentiellement mortelles. Nous étudions les dysfonctionnements immunitaires à long terme causés par le VIH-1 (SIDA) et le SRAS-CoV-2 (COVID-19) hébergés par les macrophages, les mégacaryocytes et leurs précurseurs, afin de concevoir des stratégies thérapeutiques contre VIH/SIDA et le COVID long.
Recherche
Le programme de recherche de l’équipe CVI est actuellement divisé en deux axes:
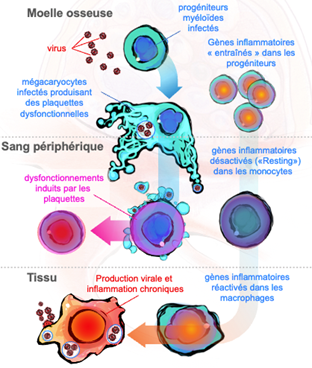
- Les macrophages sont des hôtes durables pour les agents pathogènes viraux via l’infection de progéniteurs myéloïdes communs
L’inflammation chronique est couramment observée chez les patients infectés par le VIH malgré un traitement antirétroviral et chez les personnes présentant des séquelles post-aiguës de COVID-19. Nous étudions : i) si les précurseurs des macrophages (progéniteurs myéloïdes communs) sont « entraînés » dans la moelle osseuse par un stimulus inflammatoire initial (par exemple, une infection virale primaire), puis affichent une réponse inflammatoire accrue lors d’un second stimulus (par exemple, une réinfection ou une surinfection) une fois qu’ils sont différenciés en macrophages dans les tissus ; et ii) si cette réponse induite est directement impliquée dans la réplication virale persistante dans les macrophages tissulaires, entretenant une infection et une inflammation chronique délétères pour l’homéostasie.
- Les mégacaryocytes ciblés par les virus participent à la progression des maladies infectieuses
Les mégacaryocytes, précurseurs des plaquettes, gagnent du terrain dans le domaine de l’immunologie en tant qu’acteurs du système inflammatoire/immunitaire – un sujet mal compris mais passionnant en immunologie. Nous étudions les conséquences délétères de l’infection par les mégacaryocytes pour le système immunitaire et les mécanismes cellulaires/moléculaires contrôlant la persistance virale dans cette cellule myéloïde. Notre objectif est de décrypter les facteurs exprimés dans les mégacaryocytes lors d’infections virales, l’héritage de ces facteurs par les plaquettes et leurs rôle immunomodulateur sur les cellules immunitaires lors du contact plaquettes-leukocytes. Les facteurs plaquettaires induites par le virus sont évalués fonctionnellement par blocage/inhibition à l’aide d’anticorps et de stratégies CRISPR/Cas9, dans des modèles in vitro et in vivo, ouvrant la voie à de nouvelles stratégies thérapeutiques.
Résumé des travaux récents
Bien que leur charge virale plasmatique soit indétectable grâce au traitement antirétroviral actuel, certains individus atteints du VIH et sous thérapie hébergent le VIH infectieux dans leurs plaquettes. La présence du VIH dans les plaquettes est fortement corrélée avec une faible reconstitution immunitaire malgré la thérapie. Les mégacaryocytes, dans lesquelles l’ADN proviral et l’ARN viral ont été détectés chez ces individus, semblent être l’origine probable des plaquettes hébergeant le VIH. Afin d’étudier les mécanismes permettant aux mégacaryocytes de soutenir l’infection par le VIH-1, nous avons établi des modèles in vitro d’infection virale au sein des mégacaryocytes dérivés de cellules souches hématopoïétiques CD34+ humaines et dans des lignées cellulaires mégacaryocytaires. L’intégration de l’ADN proviral du VIH dans le génome des cellules mégacaryocytaires, la production virale auto-limitée et l’accumulation du VIH dans des compartiments renfermant le virus – autant de caractéristiques illustrant l’infection virale et la persistance du VIH au sein des cellules myéloïdes – ont été établies.
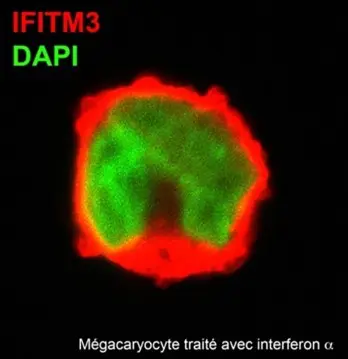
L’équipe investigue les mécanisme de désarmement des mégacaryocytes par les virus, notamment le détournement de la réponse immunitaire médiée par la protéine transmembranaire 3 induite par l’interféron (IFITM3). L’IFITM3 est un facteur antiviral exprimé de manière constitutive par les mégacaryocytes, dont l’expression est augmentée par interféron alpha. L’expression de l’IFITM3 a été inhibée par l’infection au VIH, sans affecter la maturation des mégacaryocytes infectés. Afin d’étudier l’implication de l’IFITM3 dans le cas d’une infection par le VIH, une inhibition de l’expression du gène IFTIM3 a été réalisé en utilisant la technique de gene silencing. L’étude de l’effet du silencing de l’IFTIM3 a révélé une augmentation de taux d’infection virale par le VIH dans la lignée cellulaire mégacaryocytaire. Ces résultats suggèrent globalement que le VIH détourne la réponse antivirale intrinsèque conférée aux mégacaryocytes par IFITM3. Les mégacaryocytes et les plaquettes sont des refuges largement négligés du VIH qui méritent être étudiés pour le développement de thérapies antirétrovirales améliorées et, surtout, pour parvenir à l’éradication complète de l’infection par le VIH.
Fernando REAL
CNRS CRCN, responsable de l’équipe
Numéro ORCID : 0000-0002-5060-4334
Dylan JUCKEL
Post-doctorant (Université de Lille)
Agathe BOUR
Étudiante en Master 2 (Université de Lille)
Anaïs DARDAILLON
Doctorante (Université de Lille / CIFRE)
Cyrine BENTALEB
Post-doc (Université de Lille)
Noëmie COURTIN
Assistante Ingénieure (CNRS)
Publications
Bentaleb C, Adrouche S, (…) Real F*.
HIV-1 inhibits IFITM3 expression to promote the infection of megakaryocytes
Journal of Molecular Cell Biology. 2024 Oct 1, doi: 10.1093/jmcb/mjae042
Real F, Zhu A, Belmellat A, Sennepin A, (…), Bomsel M.
S100A8-mediated metabolic adaptation controls HIV-1 persistence in macrophages in vivo
Nature Communications. 2022 doi: 10.1038/s41467-022-33401-x
Real F, Ganor Y, Bomsel M.
Experimental Models to Study HIV Latency Reversal from Male Genital Myeloid Cells.
Methods in Molecular Biology. HIV reservoirs . 2022 doi: 10.1007/978-1-0716-1871-4_14
Real F, Capron C, Sennepin A, Arrigucci R, Zhu A, (…) Bomsel M.
Platelets from cART-suppressed HIV-infected patients with poor CD4+ T cell recovery carry infectious HIV.
Science Translational Medicine. 2020 doi: 10.1126/scitranslmed.aat6263
Pessoa CC, Reis LC, (…) Real F*.
ATP6V0d2 controls Leishmania parasitophorous vacuole biogenesis via cholesterol homeostasis
PLoS Pathogens. 2019 Jun 14;15(6):e1007834. doi: 10.1371/journal.ppat.1007834
Real F, Sennepin A, Ganor Y, Schmitt A, Bomsel M.
Live Imaging of HIV-1 Transfer across T Cell Virological Synapse to Epithelial Cells that Promotes Stromal Macrophage Infection.
Cell Reports. 2018 May 8;23(6):1794-1805. doi: 10.1016/j.celrep.2018.04.028
Mots-clés
Contact équipe
Contact équipe (numéro à privilégier)
03 20 87 77 98
ou
Fernando Real
Responsable de l’équipe « Chronicity of Viral Infections »
fernando.real@cnrs.fr
03 20 87 78 02

