Dialogue inter-organes dans les pathologies cardio-métaboliques
Équipe 1 – INSERM U1011 – Université de Lille – CHU Lille – Institut Pasteur de Lille

Présentation
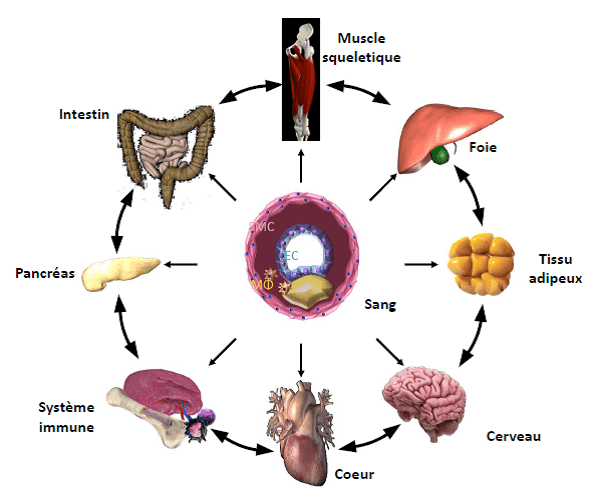
L’organisme perçoit son état énergétique grâce à une communication étroite entre les organes (foie, tissu adipeux, intestin, pancréas), qui intègrent de multiples signaux endocriniens (hormones, cytokines inflammatoires) et métaboliques (glucose, acides gras libres et métabolites intermédiaires). La dérégulation du contrôle étroit du métabolisme entraîne une dyslipidémie, un diabète, une obésité et la maladie du foie gras non alcoolique, qui prédispose aux complications cardiovasculaires. Les récepteurs nucléaires jouent un rôle clé dans l’adaptation (patho)physiologique aux modifications de l’état énergétique.
Au cours des dernières années, les recherches de l’équipe se sont concentrées sur le rôle des PPARs (activés par les acides gras, les fibrates et glitazones) et des récepteurs nucléaires FXR et TGR5 (activés par les acides biliaires) dans la régulation du métabolisme des lipides et du glucose et l’homéostasie énergétique. Afin d’obtenir de plus amples informations sur le rôle régulateur des récepteurs nucléaires dans le métabolisme et l’homéostasie énergétique, des études utilisant des modèles animaux des récepteurs nucléaires sont réalisées, ainsi que des approches moléculaires pour élucider les mécanismes moléculaires, combinées à l’étude de ligands pharmacologiques et à des études translationnelles dans des cohortes humaines. Ces approches permettront de découvrir de nouvelles stratégies thérapeutiques pour le traitement des maladies métaboliques telles que le diabète de type 2 et la dyslipidémie.
Actus
- ERC Advanced Grant : « Acides biliaires, immunométabolisme, homéostasie des lipides et du glucose”
- Fondation LEDUCQ: Réseau transatlantique d’excellence dans le domaine des maladies cardiovasculaires : « Définir et cibler les voies épigénétiques dans les monocytes et les macrophages contribuant aux maladies cardiovasculaires”
- RHU PRECINASH : “La stéato-hépatite non alcoolique, de la stratification de la maladie aux nouvelles approches thérapeutiques”
- Labex EGID
Projets transversaux
 “NASH, pathophysiologie et interventions thérapeutiques”
“NASH, pathophysiologie et interventions thérapeutiques”
La maladie du foie gras (NAFLD) est le phénotype hépatique du syndrome métabolique, pour lequel les options de traitement font défaut et dont le diagnostic par biopsie n’est pas optimal. Il est donc urgent d’identifier les mécanismes physiopathologiques du NAFLD et de la réponse au traitement. L’objectif est d’identifier les réseaux moléculaires associés au NAFLD et de découvrir des biomarqueurs et des cibles thérapeutiques potentiels pour le traitement du NASH en réalisant : 1/ des études translationnelles sur des cohortes humaines de NAFLD ; 2/ des études précliniques dans un modèle murin de NAFLD ; 3/ des études pharmacologiques sur les fonctions des récepteurs nucléaires dans le foie (RHU Precinash).
 “Acides biliaires, FXR et immunométabolisme”
“Acides biliaires, FXR et immunométabolisme”
Les chercheurs étudient le rôle des acides biliaires, agissant par l’intermédiaire du récepteur nucléaire Farnesoid X Receptor (FXR) et du récepteur membranaire couplé aux protéines G TGR5, dans le métabolisme des lipides et du glucose par: 1/ l’analyse des tissus humains (foie, intestin, tissu adipeux) ; 2/ l’étude des fonctions physiopathologiques de ces récepteurs dans les tissus métaboliques en utilisant des souris déficientes en récepteurs, 3/ des approches mécanistiques in vitro ; 4/ des études pharmacologiques (ERC Advanced Grant).
 “Mitochondries, fonction cardiaque et cardioprotection”
“Mitochondries, fonction cardiaque et cardioprotection”
Les maladies coronariennes sont la principale cause de morbidité et de mortalité dans le monde. Les patients souffrant de coronaropathie sont confrontés à une insulte d’ischémie-reperfusion (IR) myocardique, non seulement lorsqu’ils subissent un infarctus aigu du myocarde, mais aussi lors du pontage cardiopulmonaire nécessaire à la chirurgie de pontage coronarien (CABG). La prévention de la mort des cardiomyocytes après une IR est encore un besoin clinique de première ligne non satisfait. L’équipe émet l’hypothèse qu’une mauvaise fonction mitochondriale cardiaque, telle que rencontrée chez les patients diabétiques et âgés, est responsable d’une mauvaise fonction myocardique et d’une mauvaise tolérance aux IR. Elle prévoit donc que la stimulation de la fonction mitochondriale cardiaque par interférence avec la signalisation des récepteurs nucléaires est une cible pharmacologique pertinente chez ces patients. Le projet de recherche translationnelle va de l’essai clinique à l’exploration d’échantillons myocardiques humains et à la biologie moléculaire et est conçu pour apporter des preuves et des approches pertinentes pour améliorer les soins aux patients (IHU Precidiab).
Membres
Bart STAELS
PU-PH, responsable d’équipe
Numéro ORCID : 0000-0002-3784-1503
Kadiombo BANTUBUNGI
MCU
Olivier BRIAND
MCU
Sandrine CARON
MCU
Augustin COISNE
MCU-PH
Delphine EBERLE
MCU
Joël HAAS
CR Inserm
David MONTAIGNE
PU-PH
Audrey HELLEBOID
MCU
Fanny LALLOYER
MCU
Sophie LESTAVEL
PU
François PONTANA
MCU-PH
Anne MUHR-TAILLEUX
PU
Réjane PAUMELLE-LESTRELIN
PU
Laura BUTRUILLE
Post-doc
Gao VANCE
Post-doc
Sarah DUCASTEL
Post-doc
Kévin ORY
Post-doc
Eric BAUGE
Ingénieur, technicien, IPL
Emmanuelle VALLEZ
Ingénieure, technicienne, IPL
Bruno DERUDAS
Ingénieur, technicien, IPL
Emilie DORCHIES
Ingénieure, technicienne, IPL
Isabelle DUPLAN-COQUELLE
Ingénieure, technicienne, Univ
Pauline JACQUEMAIN
Ingénieure, technicienne, CDD Univ
Xavier MARECHAL
Ingénieur, technicien, Univ
Emilie NICOLAS
Ingénieure, technicienne, CDD Univ
Charlène POURPE
Ingénieure, technicienne, Univ
Véronique TOUCHE
Ingénieure, technicienne, Univ
Eloïse WOITRAIN
Ingénieure, technicienne, CDD Ass. privée
Simon PESCHARD
Étudiant en thèse
Lucie BERNARD
Étudiante en thèse
Ludivine CLAVREUL
Étudiante en thèse
Benjamin DECKMYN
Étudiant en thèse
Raphaël DECOIN
Étudiant en thèse
Audrey DEPRINCE
Étudiante en thèse
Guillaume GRZYCH
Étudiant en thèse
Doriane HENRY
Étudiante en thèse
Margaux NAWROT
Étudiant en thèse
Sandro NINNI
Étudiant en thèse
Arielle NZOUSSI-LOUBOTA
Étudiante en thèse
Staniel ORTMANS
Étudiant en thèse
Matéo ANDRIEU
Étudiant Master 2
Kubra OZKAN
Étudiant Master 2
Chloé BLONDEL
Étudiant Master 2
Nadia ESSONGHE
Étudiant Master 2
Elena DURAN-GONZALEZ
Étudiante Master 2
Viktor LIENARD
Étudiant Master 2
Publications
Montaigne D., Marechal X., Coisne A., Debry N., Modine T., Fayad G., Potelle C., El Arid JM., Mouton S., Sebti Y., Duez H., Preau S., Remy-Jouet I., Zerimech F., Koussa M., Richard V., Nevière R., Edme JL., Lefebvre P., Staels B.
Myocardial contractile dysfunction is associated with impaired mitochondrial function and dynamics in type 2 diabetic but not in obese patients.
Circulation 2014;130(7):554-64.
Trabelsi M.S., Daoudi M., Prawitt J., Ducastel S., Touche V., Sayin S.I., …, Staels B.*, Lestavel S.
Farnesoid X receptor inhibits glucagon-like peptide-1 production by enteroendocrine L cells.
Nat Commun 2015;6:7629.
Briand O., Touche V., Colin S., Brufau G., Davalos A., Schonewille M., Bovenga F., Carriere V., de Boer J.F., Dugardin C., Riveau B., Clavey V., Tailleux A., Moschetta A., Lasuncion M.A., Groen A.K., Staels B.*, Lestavel S.
Liver X receptor regulates triglyceride absorption through intestinal down-regulation of scavenger receptor class B, type 1.
Gastroenterology 2016 150:650-8.
D. Montaigne, X. Marechal, T. Modine, A. Coisne, S. Mouton, G. Fayad, S. Ninni, C. Klein, S. Ortmans, C. Seunes, C. Potelle, A. Berthier, C. Gheeraert, C. Piveteau, R. Deprez, J. Eeckhoute, H. Duez, D. Lacroix, B. Deprez, B. Jegou, M. Koussa, J.L. Edme, P. Lefebvre, B. Staels.
Daytime variation of perioperative myocardial injury in cardiac surgery and its prevention by Rev-erba antagonism: a single-centre propensity-matched cohort study and a randomised study.
The Lancet, 2018, 391, 59-69.
Paumelle R., Haas J.T., Hennuyer N., Bauge E., Deleye Y., Mesotten D., Langouche L., Vanhoutte J., Cudejko C., Wouters K., Hannou S.A., Legry V., Lancel S., Lalloyer F., Polizzi A., Smati S., Gourdy P., Vallez E., Bouchaert E., Derudas B., Dehondt H., Gheeraert C., Fleury S., Tailleux A., Montagner A., Wahli W., Van den Berghe G., Guillou H., Dombrowicz D., Staels B.
Hepatic PPARα is critical in the metabolic adaptation to sepsis.
J. Hepatol., 2019 ; 70, 963-973.
Mots-clés
Physiologie ; Métabolisme et nutrition ; Désordres métaboliques ; Récepteurs nucléaires