INSERM U1011 – Université de Lille – CHU Lille – Institut Pasteur de Lille

Présentation
L’endothélium joue un rôle indispensable dans tous les tissus, et ses dysfonctionnements contribuent à une variété de troubles cardiovasculaires, y compris l’athérosclérose, et le cancer. Cibler les vaisseaux sanguins dysfonctionnels représente donc une piste prometteuse pour le développement de thérapies visant à prévenir ou traiter ces maladies.
Notre recherche vise à caractériser le rôle du dysfonctionnement des cellules endothéliales dans l’apparition des maladies cardiovasculaires et du cancer. Plus précisément, nous nous intéressons à la plasticité des cellules endothéliales et à leur reprogrammation métabolique en tant que moteurs de la progression de la maladie.
Les principales investigations de notre équipe sont axées sur la transition endothéliale-mésenchymateuse (EndMT), un processus par lequel les cellules endothéliales perdent leur identité et acquièrent des caractéristiques pathologiques de cellules mésenchymateuses.
En combinant nos expertises multidisciplinaires et en utilisant des approches moléculaires et cellulaires avancées, ainsi que des modèles précliniques in vivo, notre équipe s’efforce de déchiffrer les mécanismes complexes régulant l’EndMT et d’identifier de nouvelles cibles thérapeutiques. Notre travail s’inscrit dans une démarche translationnelle visant à traduire à long terme nos découvertes en applications cliniques pour améliorer la prise en charge des patients atteints de maladies cardiovasculaires et de cancer.
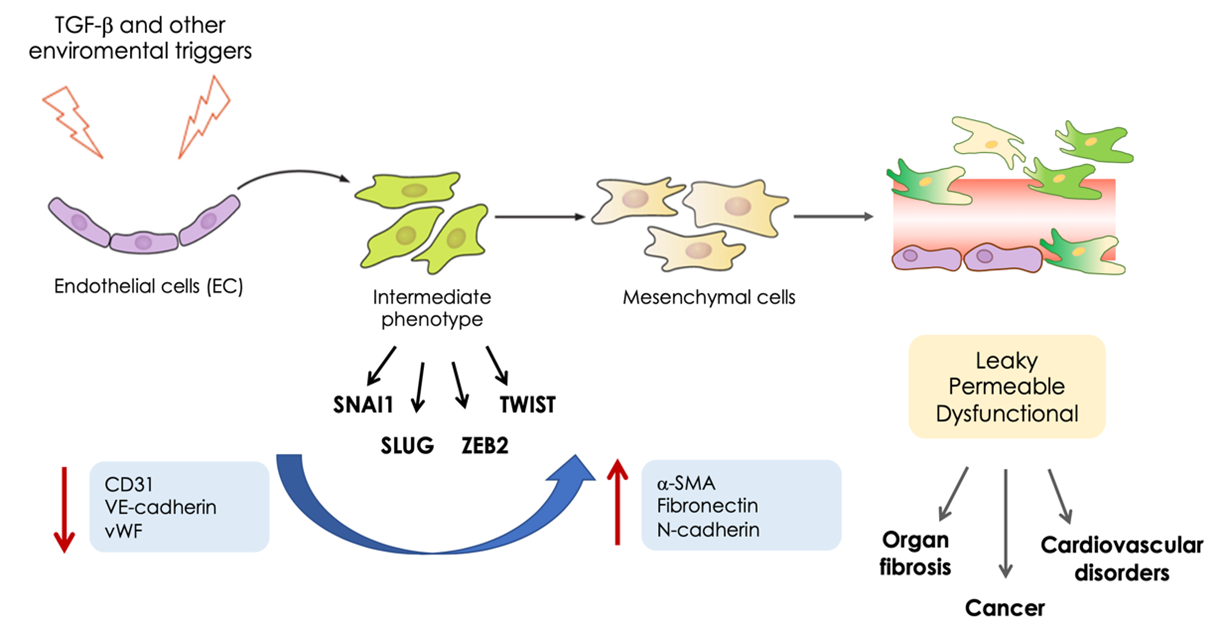
Processus de EndMT: Suite à des stimuli environnementaux, les Cellules Endotheliales (CE) perdent progressivement leur identité en régulant à la negativement les marqueurs endothéliaux canoniques (CD31, VE-cadhérine, vWF) et en acquérant l’expression de marqueurs mésenchymateux (a-SMA, fibronectine, N-cadhérine) et de facteurs de transcription (SNAI1, SLUG, ZEB2, TWIST), ce qui conduit à des vaisseaux dysfonctionnels.
Projets
 PROJET 1 (Louay BETTAIEB; Alina ERRERD) – Financeur : Université de Lille ; Erasmus+ / Inserm
PROJET 1 (Louay BETTAIEB; Alina ERRERD) – Financeur : Université de Lille ; Erasmus+ / Inserm
Une nouvelle stratégie thérapeutique pour cibler la voie de signalisation dysfonctionelle AIF/CHCHD4 – A novel anti-angiogenic strategy targeting dysfunctional AIF/CHCHD4 pathway
(Collaboration : Dr Fabrice SONCIN, LiMMS/IIS, Lille ; Dr Nazanine MODJTAHEDI, UMR CNRS 5261 – INSERM U1315 – Université Claude Bernard Lyon)
Les mitochondries sont essentielles pour l’énergie cellulaire et le métabolisme. Pour fonctionner correctement, les mitochondries importent des protéines via un mécanisme dont l’élément central est la protéine CHCHD4. Toute dérégulation de cette voie est associée à un dysfonctionnement cellulaire et, à terme, à une maladie.
Nous explorons cette voie dans les cellules endothéliales, qui sont cruciales pour la santé vasculaire. En réduisant CHCHD4 dans ces cellules, nous observons des effets sur les fonctions endothéliales, ainsi que sur le métabolisme mitochondrial. Ces résultats suggèrent un rôle clé de CHCHD4 dans la physiologie des cellules endothéliales, offrant de nouvelles pistes pour le traitement des anomalies vasculaires.
 PROJET 2 (Amani MACHMOUCHI ; Fabiola SILVA ANGULO) – Financeur : Université de Lille
PROJET 2 (Amani MACHMOUCHI ; Fabiola SILVA ANGULO) – Financeur : Université de Lille
Découverte des signatures génétiques de transition endothélio-mésenchymateuse dans l’angiogenèse pathologique
(Collaboration: Pr Dimitra GKIKA, CANTHER, Lille)
Ce projet vise à explorer la transition endothéliale-mésenchymateuse (EndMT), un processus crucial dans les pathologies telles que le cancer et l’athérosclérose. Dans la continuité de nos travaux préliminaires qui ont identifié le rôle de la signalisation calcique dans l’EndMT physiologique, ce projet examine les mécanismes de l’EndMT pathologique et cherchera à identifier une signature génique spécifique à cette transition. Nous utilisons des approches omiques avancées, des modèles in vitro et in vivo, et évaluons la possibilité de cibler la signalisation calcique pour inhiber l’EndMT. Ces recherches pourraient ouvrir de nouvelles voies thérapeutiques pour les pathologies associées à l’EndMT.
 PROJET 3 (Evan COURMONT) – Financeur : Région HdF-Pasteur
PROJET 3 (Evan COURMONT) – Financeur : Région HdF-Pasteur
Le rôle des récepteurs nucléaires dans la fonction des cellules endothéliales
(Collaboration: Pr Dimitra GKIKA, CANTHER, Lille)
Les récepteurs nucléaires (RN) sont une famille de facteurs de transcription régulés par des ligands et activés par des signaux solubles dont les lipides. Une fois activés, les RN contrôlent la transcription des gènes impliqués dans divers processus biologiques, notamment la prolifération, la différenciation et le métabolisme.
Le système vasculaire est à l’interface entre la circulation sanguine et les tissus sous-jacents et, en tant que tel, il est exposé à plusieurs activateurs de NR. Malgré les preuves soulignant le rôle des NR dans la biologie vasculaire, nous avons encore une connaissance limitée des mécanismes d’action dans les cellules d’origine vasculaire.
L’objectif de ce projet est de développer un atlas des NR dans les cellules endothéliales humaines afin d’identifier des candidats récepteurs potentiels qui pourraient jouer un rôle dans la stabilité vasculaire.
 PROJET 4 (Mauro VEDELAGO; Cyril ROBIL) – Financeur : INCa-DGOS
PROJET 4 (Mauro VEDELAGO; Cyril ROBIL) – Financeur : INCa-DGOS
Disséquer l’hétérogénéité métabolique pour augmenter l’efficacité de l’immunothérapie
(Collaboration: Pr Guillaume PIESSEN, CHU Lille)
L’hétérogénéité métabolique est un facteur déterminant de la fonction du tissu et, dans de nombreuses maladies, contribue à la réponse au traitement. C’est le cas des tumeurs, où les différentes cellules du microenvironnement s’engagent dans un dialogue métabolique croisé avec d’autres cellules stromales (par exemple, entre les cellules endothéliales et les fibroblastes) et/ou des cellules immunitaires pour acquérir un phénotype dysfonctionnel contribuant à la progression de la maladie et à la résistance aux thérapies. Dans le cadre de ce projet, nous visons à disséquer l’hétérogénéité métabolique au sein du cancer de l’œsophage hautement agressif et resistant au traitement. Grâce à une approche translationnelle utilisant des tissus humains et des technologies de pointe, y compris l’omique, nous évaluons comment l’hétérogénéité métabolique entre les différentes populations cellulaires contribue aux mécanismes associés à la résistance aux inhibiteurs de points de contrôle immunitaire. L’objectif final est d’identifier de nouvelles cibles métaboliques dans les cellules endothéliales qui peuvent être exploitées pour améliorer la survie globale des patients atteints de cancer de l’œsophage et surmonter les limites thérapeutiques actuelles.
Projets transversaux
 Cibler la plasticité des cellules endothéliales pour inhiber la progression et la résistance des leucémies aigues pediatriques
Cibler la plasticité des cellules endothéliales pour inhiber la progression et la résistance des leucémies aigues pediatriques
(Collaboration : Dr Diana PASSARO, Institut Cochin, Paris; Dr Leïla PERIE’, Curie Institute, Paris – Financeur : La Ligue Contre Le Cancer)
 Effets des antibiotiques ionophores sur les fonctions des cellules endothéliales
Effets des antibiotiques ionophores sur les fonctions des cellules endothéliales
(Collaboration : Pr Luigi LANZA, University of Padua, Italy)
Financements

Membres
Alumnis
LEBAS Mathilde
Ingénieure d’étude
CHAMLALI Mohamed
Chercheur Post Doctoral
Publications
Lebas M, Chinigò G, Courmont E, Bettaieb L, Machmouchi A, Goveia J, Beatovic A, Van Kerckhove J, Robil C, Angulo FS, Vedelago M, Errerd A, Treps L, Gao V, Delgado De la Herrán HC, Mayeuf-Louchart A, L’homme L, Chamlali M, Dejos C, Gouyer V, Garikipati VNS, Tomar D, Yin H, Fukui H, Vinckier S, Stolte A, Conradi LC, Infanti F, Lemonnier L, Zeisberg E, Luo Y, Lin L, Desseyn JL, Pickering J, Kishore R, Madesh M, Dombrowicz D, Perocchi F, Staels B, Pla AF, Gkika D, Cantelmo AR.
Integrated single-cell RNA-seq analysis reveals mitochondrial calcium signaling as a modulator of endothelial-to-mesenchymal transition
Sci Adv. 2024 Aug 9;10(32)
Chinigò G, Grolez GP, Audero M, Bokhobza A, Bernardini M, Cicero J, Toillon RA, Bailleul Q, Visentin L, Ruffinatti FA, Brysbaert G, Lensink MF, De Ruyck J, Cantelmo AR, Fiorio Pla A, Gkika D.
TRPM8-Rap1A Interaction Sites as Critical Determinants for Adhesion and Migration of Prostate and Other Epithelial
Cancer Cells. Cancers (Basel). 2022 Apr 30;14(9):2261.
Veys K, Fan Z, Ghobrial M, Bouché A, García-Caballero M, Vriens K, Conchinha NV, Seuwen A, Schlegel F, Gorski T, Crabbé M, Gilardoni P, Ardicoglu R, Schaffenrath J, Casteels C, De Smet G, Smolders I, Van Laere K, Abel ED, Fendt SM, Schroeter A, Kalucka J, Cantelmo AR, Wälchli T, Keller A, Carmeliet P, De Bock K.
Role of the GLUT1 Glucose Transporter in Postnatal CNS Angiogenesis and Blood-Brain Barrier Integrity.
Circ Res. 2020 Jul 31;127(4):466-482.
Dejos C, Gkika D, Cantelmo AR.
The Two-Way Relationship Between Calcium and Metabolism in Cancer
Cell Dev. Biol., 2020 Nov 13;8:573747.
Eelen G*, Dubois C*, Cantelmo AR, Goveia J, Brüning U, DeRan M, Jarugumilli G, van Rijssel J, Saladino G, Comitani F, Zecchin A, Rocha S, Chen R, Huang H, Vandekeere S, Kalucka J, Lange C, Morales-Rodriguez F, Cruys B, Treps L, Ramer L, Vinckier S, Brepoels K, Wyns S, Souffreau J, Schoonjans L, Lamers WH, Wu Y, Haustraete J, Hofkens J, Liekens S, Cubbon R, Ghesquière B, Dewerchin M, Gervasio FL, Li X, van Buul JD, Wu X, Carmeliet P. *equal contribution
Role of glutamine synthetase in angiogenesis beyond glutamine synthesis.
Nature. 2018 Sep;561(7721):63-69.
Conradi LC*, Brajic A*, Cantelmo AR*, Bouché A, Kalucka J, Pircher A, Brüning U, Teuwen LA, Vinckier S, Ghesquière B, Dewerchin M, Carmeliet P. *equal contribution
Tumor vessel disintegration by maximum tolerable PFKFB3 blockade.
Angiogenesis. 2017 Nov;20(4):599-613.
Cantelmo AR*, Conradi LC*, Brajic A*, Goveia J*, Kalucka J, Pircher A, Chaturvedi P, Hol J, Thienpont B, Teuwen LA, Schoors S, Boeckx B, Vriens J, Kuchnio A, Veys K, Cruys B, Finotto L, Treps L, Stav-Noraas TE, Bifari F, Stapor P, Decimo I, Kampen Kim, De Bock K, Haraldsen G, Schoonjans L, Rabelink T, Eelen G, Ghesquière, B, Rehman J, Lambrechts D, Malik AB, Dewerchin M, & Carmeliet P. *equal contribution
Inhibition of the glycolytic activator PFKFB3 in endothelial cells induces tumor vessel normalization, impairs metastasis and improves chemotherapy
Cancer Cell. 2016 Dec 12;30(6):968-985.
Mots-clés
#biologievasculaire #cellulesendothéliales #plasticitéendothéliale #perméabilitévasculaire #métabolisme #récepteursnucléaires #hétérogénéitémétabolique
Contact équipe
Anna Rita CANTELMO
Responsable d’Equipe
Numéro ORCID :
0000-0002-2748-264X
anna-rita.cantelmo@univ-lille.fr
+33 3 20 87 71 48
