Chronicité des Infections Virales [CVI]

Présentation
L’équipe « Chronicité des Infections Virales » étudie les mécanismes moléculaires et cellulaires liés à la persistance des pathogènes dans les cellules myéloïdes. Nos objectifs sont : I) d’investiguer de nouvelles stratégies pour neutraliser les agents pathogènes avant qu’ils se cachent et se protègent dans des réservoirs tissulaires ou cellulaires (tels que les macrophages et autres cellules myéloïdes, y compris leurs progéniteurs hématopoïétiques) et également de cibler la propagation de l’agent pathogène à partir de ces niches cellulaires; II) d’étudier les mécanismes de latence des pathogènes intracellulaires responsables de la persistance de la maladie; et III) contribuer au développement d’approches thérapeutiques efficaces pour lutter contre les infections virales chroniques et potentiellement mortelles. Actuellement, nous abordons les dysfonctionnements immunitaires à long terme causés par le VIH-1 et le SRAS-CoV-2 hébergés par les macrophages, les mégacaryocytes et leurs précurseurs, afin de concevoir des stratégies thérapeutiques améliorées contre VIH/SIDA et le COVID long.
Le virus de l’immunodéficience humaine (VIH), l’agent responsable du SIDA, est un problème majeur de santé publique depuis plus de 40 ans. Le VIH provoque une immunosuppression de l’hôte par l’infection, la multiplication et la persistance dans les cellules immunitaires myéloïdes et lymphoïdes, qui peuvent se transformer en réservoirs viraux. L’équipe du Dr Fernando Real vise à détecter et à mieux caractériser ces cellules, en particulier les cellules myéloïdes comme les macrophages et les mégacaryocytes, et à comprendre les mécanismes cellulaires et moléculaires qui sous-tendent leur maintien et leur action délétère sur le système immunitaire. L’équipe cherche à savoir si les réservoirs viraux sont des cellules inflammatoires qui soutiennent la production de virus et de composants viraux qui compromettent la fonction et la génération de nouvelles cellules immunitaires. Ces recherches pourraient ouvrir de nouvelles voies thérapeutiques pour traiter les infections virales persistantes et leurs séquelles à long terme.
Actus
- Le programme de recherche de l’équipe émergente CVI est actuellement divisé en deux axes de recherche :
- Les macrophages sont des hôtes durables pour les agents pathogènes viraux via l’infection de progéniteurs myéloïdes communs
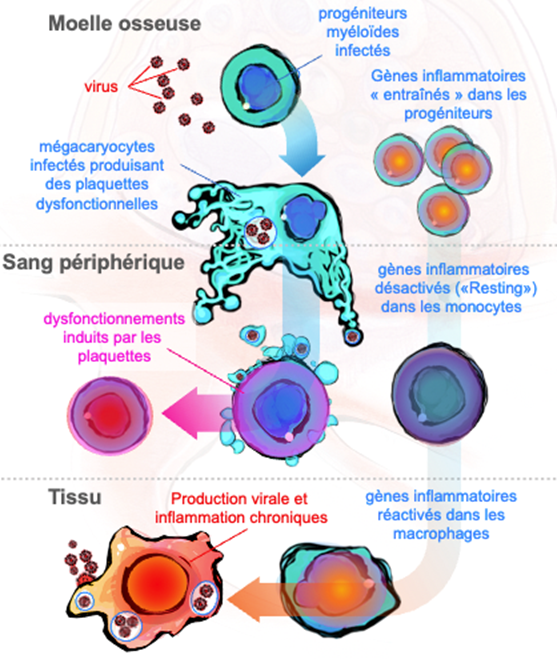
L’inflammation chronique est couramment observée chez les patients infectés par le VIH malgré un traitement antirétroviral et chez les personnes présentant des séquelles post-aiguës de COVID-19. Nous étudions : i) si les précurseurs des macrophages (progéniteurs myéloïdes communs) sont « entraînés » dans la moelle osseuse par un stimulus inflammatoire initial (par exemple, une infection virale primaire), puis affichent une réponse inflammatoire accrue lors d’un second stimulus (par exemple, une réinfection ou une surinfection) une fois qu’ils sont différenciés en macrophages dans les tissus ; et ii) si cette réponse induite est directement impliquée dans la réplication virale persistante dans les macrophages tissulaires, entretenant une infection et une inflammation chronique délétères pour l’homéostasie.
- Les mégacaryocytes ciblés par les virus participent à la progression des maladies infectieuses
Les mégacaryocytes, précurseurs des plaquettes, gagnent du terrain dans le domaine de l’immunologie en tant qu’acteurs du système inflammatoire/immunitaire – un sujet mal compris mais passionnant en immunologie. Nous étudions les conséquences délétères de l’infection par les mégacaryocytes pour le système immunitaire et les mécanismes cellulaires/moléculaires contrôlant la persistance virale dans cette cellule myéloïde. Notre objectif est de décrypter les facteurs exprimés dans les mégacaryocytes lors d’infections virales, l’héritage de ces facteurs par les plaquettes et leurs rôle immunomodulateur sur les cellules immunitaires lors du contact plaquettes-leukocytes. Les facteurs plaquettaires induites par le virus seront évalués fonctionnellement par blocage/inhibition à l’aide d’anticorps et de stratégies CRISPR/Cas9, dans des modèles in vitro et in vivo, ouvrant la voie à de nouvelles stratégies thérapeutiques.
Financement : CNRS, Région Hauts-de-France, SIDACTION
Informations : https://www.ciil.fr/teams/chronicity-of-viral-infections-cvi
Membres
Fernando REAL
CNRS CRCN, responsable de l’équipe
Numéro ORCID : 0000-0002-5060-4334
Christelle DEVISME
Post-doc (CNRS)
Cyrine BENTALEB
Post-doc (Université de Lille)
Souad ADROUCHE
Etudiante en Master 2 (Université de Poitiers)
Publications
Real F, Zhu A, Belmellat A, Sennepin A, (…), Bomsel M.
S100A8-mediated metabolic adaptation controls HIV-1 persistence in macrophages in vivo.
Nature Communications, 2022 doi: 10.1038/s41467-022-33401-x
Real F, Ganor Y, Bomsel M
Experimental Models to Study HIV Latency Reversal from Male Genital Myeloid Cells
Methods in Molecular Biology. HIV reservoirs 2022. doi: 10.1007/978-1-0716-1871-4_14
Real F, Capron C, Sennepin A, Arrigucci R, Zhu A, (…) Bomsel M.
Platelets from cART-suppressed HIV-infected patients with poor CD4+ T cell recovery carry infectious HIV
Science Translational Medicine. 2020 doi: 10.1126/scitranslmed.aat6263
Pessoa CC, Reis LC, (…) Real F
ATP6V0d2 controls Leishmania parasitophorous vacuole biogenesis via cholesterol homeostasis
PLoS Pathogens. 2019 Jun 14;15(6):e1007834.doi: 10.1371/journal.ppat.1007834
Real F, Sennepin A, Ganor Y, Schmitt A, Bomsel M.
Live Imaging of HIV-1 Transfer across T Cell Virological Synapse to Epithelial Cells that Promotes Stromal Macrophage Infection
Cell Reports. 2018 May 8;23(6):1794-1805. doi: 10.1016/j.celrep.2018.04.028
Mots-clés
Contact équipe
Responsable de l’équipe « Chronicity of Viral Infections »
fernando.real@cnrs.fr
03 20 87 12 01
