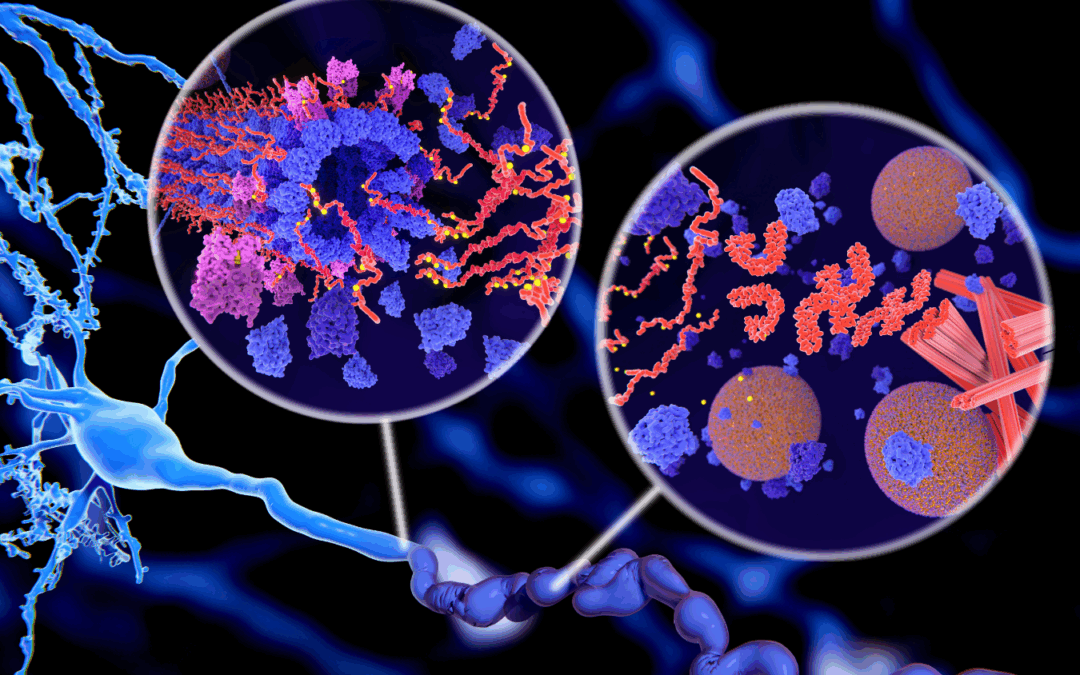
Spécialiste de la structure des protéines la Dr. Isabelle Landrieu, directrice de recherche CNRS à l’Institut Pasteur de Lille, consacre ses travaux à la protéine Tau, impliquée dans les maladies neurodégénératives. Aux côtés de ses collaborateurs, elle explore une piste innovante : l’utilisation de nanocorps, de minuscules anticorps capables de bloquer la propagation de Tau dans le cerveau. Des avancées prometteuses qui ouvrent la voie à de nouveaux espoirs thérapeutiques.

La Dr. Isabelle Landrieu, directrice de recherche CNRS et responsable de l’équipe “Biologie structurale intégrative” à l’Institut Pasteur de Lille.
Qu’est-ce qui vous a conduit à vous intéresser à la structure des protéines et à leur rôle dans les maladies neurodégénératives ?
Isabelle Landrieu (IL) : Je dirais que tout est parti de rencontres. La structure des protéines m’a toujours fascinée, depuis mes études en biochimie. J’ai eu l’occasion de faire mon master à Lille, dans un laboratoire hébergé à l’Institut de Biologie de Lille. C’est là que j’ai découvert la résonance magnétique nucléaire (RMN) et ses possibilités. À l’époque, je travaillais surtout sur des peptides, puis cela a évolué vers des protéines.
C’est en arrivant à Lille avec mon poste au CNRS que la maladie d’Alzheimer est entrée dans mon parcours, grâce à ma rencontre avec le Dr Luc Buée, qui travaillait depuis longtemps sur la protéine Tau. De mon côté, je me suis intéressée à des enzymes susceptibles de modifier Tau, en particulier certaines kinases responsables de sa phosphorylation. Cette expertise complémentaire a donné lieu à une vraie synergie et c’est ainsi que j’ai commencé à travailler sur Tau. Donc oui, c’est une histoire de rencontres, mais aussi d’expertises qui se sont bien combinées.
Et je voudrais ajouter que, par la suite, de nombreux jeunes chercheurs ont rejoint ce projet. Nous en sommes déjà à la quatrième thèse consacrée à ce sujet. Ces jeunes chercheurs ont apporté leurs idées, leur dynamisme, et ont vraiment contribué à faire avancer le projet.
Que fait la protéine tau dans le cerveau, et pourquoi devient-elle dangereuse dans la maladie d’Alzheimer ?
IL : Tau est une protéine aux fonctions multiples. Historiquement, on la connaissait surtout pour son rôle dans la stabilisation de l’architecture des neurones. Mais on sait aujourd’hui qu’elle a aussi des fonctions dans le noyau ou encore dans la signalisation cellulaire.
Dans la maladie d’Alzheimer, le problème, c’est qu’elle s’accumule et forme des agrégats. Ces amas, qu’ils soient sous forme de fibres solides ou de petits agrégats encore solubles, perturbent le fonctionnement de la cellule. Les agrégats solubles, en particulier, sont très toxiques : non seulement ils bloquent le fonctionnement normal des neurones, mais en plus ils ont la capacité de se propager d’une cellule à l’autre, contribuant à l’expansion de la maladie dans différentes zones du cerveau. À plus long terme, l’accumulation massive finit par détruire les neurones.
Nous avons commencé à travailler avec ces nanocorps car ils ont des propriétés très particulières. Ce sont de tout petits fragments d’anticorps capables de reconnaître leur cible avec une grande spécificité. Leur taille réduite leur permet d’accéder à des zones inaccessibles aux anticorps classiques.
Vous venez de publier un travail prometteur sur de “petits anticorps”, les nanocorps En quoi sont-ils innovants pour bloquer la propagation de tau ?
IL : Oui. Nous avons commencé à travailler avec ces nanocorps car ils ont des propriétés très particulières. Ce sont de tout petits fragments d’anticorps capables de reconnaître leur cible avec une grande spécificité. Leur taille réduite leur permet d’accéder à des zones inaccessibles aux anticorps classiques. Et surtout, on peut les exprimer directement à l’intérieur des cellules, ce qui n’est pas possible avec les anticorps plus gros.
Notre idée de départ était de cibler Tau dans la cellule, pour empêcher sa transformation d’une forme normale en une forme pathologique. Et dans notre dernière publication, nous avons aussi montré que ces nanocorps peuvent bloquer l’entrée dans la cellule des petits agrégats toxiques de Tau responsables de la propagation, en occupant les récepteurs d’accès.
Ce qui nous intéresse, c’est que l’immunothérapie est une voie déjà explorée contre la maladie d’Alzheimer, avec des anticorps monoclonaux qui commencent à arriver sur le marché. Mais ces traitements restent compliqués à utiliser. Les nanocorps pourraient apporter des solutions à certaines limites actuelles. Pour l’instant, nous restons au stade préclinique, mais les résultats sont très encourageants.
Et là encore, c’est une histoire de rencontre : celle avec Jean-Christophe Rain, qui dirige la société Hybrigenics à Paris. C’est lui qui a généré les premiers nanocorps avec lesquels nous avons travaillé.
IL : Aujourd’hui, dans mon équipe, nous travaillons encore à optimiser ces nanocorps, à améliorer leurs propriétés pour les rendre les plus efficaces possible. Notre rôle en laboratoire est de démontrer leur potentiel au stade préclinique.
La suite passera forcément par une structure extérieure, une entreprise capable de porter le projet vers les essais cliniques. C’est une étape qui demandera des investissements et un cadre réglementaire adapté. Dans un monde idéal, si nos recherches aboutissent, cela pourrait déboucher sur de nouveaux traitements. Pas seulement pour la maladie d’Alzheimer d’ailleurs, mais aussi pour d’autres tauopathies, parfois plus rapides et sévères, et qui pourraient constituer des indications privilégiées au départ.
L’idée, c’est de délivrer ces nanocorps dans les neurones via la thérapie génique : la cellule exprimerait elle-même le nanocorps. Cela demanderait évidemment des tests de sécurité très poussés, mais cela ouvre la perspective d’une injection unique, capable de ralentir fortement le développement de la maladie.
Quand on a commencé il y a dix ans, cela paraissait un peu de la science-fiction. Mais aujourd’hui, on voit que des approches similaires sont déjà en essai clinique, par exemple pour traiter la dégénérescence maculaire en ophtalmologie. Certes, c’est l’œil, pas le cerveau, mais cela montre que la faisabilité progresse. Et ici même à Lille, des essais existent déjà avec des injections directes dans le cerveau.
Donc nous espérons que toutes ces avancées convergeront : la maturation des technologies de délivrance, l’acceptation clinique et nos propres travaux sur Tau. Si tout se réunit, alors oui, il y a de vrais espoirs pour les patients.